��������J���j��I�Z�p�̑n��
�Đ���ẤC����܂ŗL���Ȏ��Ö@�̂Ȃ�������a�̍������\�ɂ���v�V�I��ÂƂ��đ傫�Ȋ��҂��W�߂邪�C���̎��p���ƕ��y�Ɍ����Ă͍������ׂ��ۑ肪����B������2017�N�ɓ��{�ő勉�̃o�C�I���f�B�J���N���X�^�[�ł���_�ˈ�ÎY�Ɠs�s�ɓ����_�˃��{���J�݂��C�����Ǝ��̊��S���n�����|�{�Z�p���j�ɁC�Đ���Â̎�v�ۑ�ł���זE�̈���I�����ƃR�X�g�̍������ɂ��C�Đ���Â̕��y���߂����Ă���B
�{�e�ł́CiPS�זE�𗘗p�����Ԗ�������p�[�L���\���a�����Ɋ�^����Đ���Â̎��p���ƎY�Ɖ��Ɍ����āC�A�J�f�~�A�Ȃ�тɎY�ƊE�̃g�b�v���[�_�[�ƂƂ��ɃI�[�v���C�m�x�[�V�����Ő��i���Ă���őO���ł̎��g�݂ɂ��ďq�ׂ�B







2006�N�ɋ��s��w�̎R���L�틳����ɂ��q�g�l�H���\�����זE�miPS�זE�iinduced Pluripotent Stem Cell�j�n1�j���n�����ꂽ�B���ꂩ��10�N�ȏオ�o�߂��C���{���̌������ʂł���iPS�זE�͍Đ���Â̕���ɂ����āC���܂��܂ȓ���̎����ɑ���v�V�I�Ȏ��Â��x�����ՂƂ��āC���̎��p���Ɍ����ĐV���Ȓi�K���}���Ă���B���̂悤�ȏ�w�i�ɓ����́C�Đ���Â̕��y�ւ̍v�����߂����C2002�N�x���犮�S���n������Ƃ���זE�����|�{���u�̊J�����s���Ă����B2017�N�ɂ͌����J�����_����ʌ����R�����畺�Ɍ��_�ˎs�̐_�ˈ�ÎY�Ɠs�s�Ɉړ]���C�ϋɓI�ɃI�[�v���C�m�x�[�V�����𐄐i���Ă���B�܂��C�Đ���Õ���̃g�b�v���[�_�[�Ƃ̋��n�ɂ��J�����������Ă���B����ɂ��C��×p�̍זE�����ɂ����鎩���|�{���u�̎��p���Ɍ����Ď��g��ł���B
�{�e�ł�,�_�ˈ�ÎY�Ɠs�s�ɂ���������_�˃��{�̎��g�݂��Љ��ƂƂ��ɁC�Đ���Â������ɂ��čl�@����B
�Đ���Â̎s��K�͂́C���܂��܂Ȏ����ɑ���iPS�זE�R���̍זE�̗Տ����p���Ɍ��������g�݂��㉟������`�ŁC2020�N�ȍ~�Ɏs�ꂪ�}�������邱�Ƃ������܂�Ă���C2030�N�ɂ͐��E�K�͂�17���~�̎s��Ɋg�傷��Ɨ\������Ă���2�j�B
���������J���@�l�����w����������������v���W�F�N�g���[�_�[��́C2014�N�C���E�ŏ��߂Ċ��Ҏ��g�̕\��g�D����쐻����iPS�זE�R���̖Ԗ��F�f���iRPE�FRetinal Pigment Epithelium�j�זE�V�[�g������Ǖϐ��̊��҂ɈڐA�i���ƈڐA�j���C�p��2�N�̌o�߂��ǍD�ł��������Ƃ����3�j�B���̋Ɛт͍����]���������CiPS�זE���玡�×p�זE�����������܂ŁC�|�{�E���H�Ȃ�тɕi���]�����܂߂����ԂƃR�X�g������͑傫�ȉۑ�ƂȂ��Ă���B2017�N�ɂ͋��s��wiPS�זE�������iCiRA�FCenter for iPS Cell Research and Application�j�̌���h�i�[�R����iPS�זE�X�g�b�N����쐻����RPE�זE�����t�����҂̖Ԗ��ɈڐA�i���ƈڐA�j����Տ��������J�n���ꂽ�B2018�N�ɂ́C���s��wCiRA�������~�����炪���I��Õی��̓K�p���߂����CiPS�זE�X�g�b�N����h�p�~���_�o�O��זE�����ăp�[�L���\���a���҂̔]�ɈڐA�i���ƈڐA�j�����t�哱�������J�n�����B����ɁCiPS�זE��p��������w�̏d�ǐS�s�S�C�p�������C�c��`�m��w�̐Ґ��������҂ւ̈ڐA���Â��Տ������Ƃ��ċ߂��J�n�����\��ł���B
�Đ���Âł́C���Ҏ��g�̍זE���ڐA���鎩�ƈڐA�ƁC���҂̍זE���ڐA���鑼�ƈڐA���s���Ă���BiPS�זE��p�����Đ���Âɂ����Ď��ƈڐA�́C�Ɖu����̉\���͌���Ȃ����������̂́C�ʂɊ��Җ{�l�̑̐��זE����iPS�זE���쐻���C���̂ǖړI�̑g�D��זE�����邽�߁C�O�q�̂Ƃ��蒲���ɂ����鎞�Ԃƍ��z�ȃR�X�g���ۑ�ƂȂ�B������ƈڐA�́C���҂�iPS�זE���ʂɍ쐻���C�K�v�ɉ����ĖړI�̑g�D��זE�����邽�߁C���ƈڐA�Ɣ�r���ăR�X�g�ጸ�������߂�B�����ŋ��s��wCiRA�͖Ɖu���┽���Ɋւ��q�g�������R���iHLA�FHuman Leucocyte Antigen�j�̌^�����┽�����N���ɂ����g�ݍ��킹�ŗL���錒��{�����e�B�A����畆�⌌�t���̎悵�C�����Ɋ܂܂��זE����iPS�זE���쐻���āC���܂��܂ȕi���]�����s���������ŁC�Đ���×piPS�זE�X�g�b�N�Ƃ��ĕۑ����C2015�N�����ÁE�����@�ւ��Ƃւ̒��J�n�����B2018�N�����_�œ��{�l�̖�32����HLA�^���J�o�[����Ă���4�j�C���̃X�g�b�N�̒����犳�҂�HLA�^�ɑ�������iPS�זE��p���ĖړI�̑g�D��זE�����Ď��Âɗp����C���ƈڐA�ł����Ă��Ɖu�����ጸ�ł���Ɗ��҂���Ă���B
�����iPS�זE��p������Â̖{�i�����������C���i����iPS�זE�R���זE���i�������I�ȉ��i�Œ��C����I�Ɋ��҂ɓ͂��邽�߂ɂ́C���̗ʎY���Ɍ������ۑ�����������Ă������Ƃ��d�v�ł���B���݈ڐA�ɓK�������S�Ȏ��×p�זE�̐����́C�|�{�N���[�����[�����ł̐��Z�p�҂̎��Ɓi��Z�j�ɂ��|�{���������Ȃ����C�|�{�ݔ��̈ێ��Ǘ����l������z�ȃR�X�g�̗v���̈�ɂȂ��Ă���B�܂��C�זE�i������Ǝ҂̃X�L���Ɉˑ�����ꍇ������C�ڐA�p�r�ɋ��߂���i�����ǂ̂悤�ɒS�ۂ��邩���זE�����ɂ�����d�v�ȗv�f�ł���B����ɐl����Ƃ��邱�ƂɋN������R���^�~�l�[�V�����i�����w�I�����j���z�肳��郊�X�N�ƂȂ�B
�����̉ۑ������̋Z�p�ʼn�������ׂ��C�����_�˃��{�ł͍Đ���×p�זE�����|�{�Z�p�̊J���Ɏ��g��ł����B
�����̍זE�����|�{�Z�p�̊J���J�n��2002�N�x�ɂ����̂ڂ�C���̌�15�N�ɂ킽��J���̌��ʁC���݂̓����Ǝ��̊��S���n�זE�����|�{�Z�p���m������Ɏ������B�}1�ɏ]���@�Ɗ��S���n�|�{�̊T�O�}�������B
�]���@���CCO2�C���L���x�[�^�[����S�L���r�l�b�g���ł̊J���n���삨��є|�{�ł������̂ɑ��C���S���n�͍��{�I�ɈقȂ�T�O�ō\������Ă���B���S���n�ł́C�|�{�e���|�{�t�p�̃{�g����o�b�N���`���[�u�ŘA�����C���ׂĂ̖��[��������|�{���W���[�����쐻���C�K���}���Ǝ˂ɂ�胂�W���[��������ŋۂ���B����u�P�������ɃZ�b�g������C�זE�����t�ۓI�Ƀ��W���[���ɐڑ����C�|�{���J�n����B�|�{�ɕK�v��5��CO2�����K�X�́C�{���x����f�B�X�N�t�B���^�i0.22 ��m�E�a�j��ʂ��ă`���[�u�o�R�ʼn����{�g����ʉߌ�ɔ|�{�e��ɊԌ����C����B�|�{�t�̓y���X�^�|���v��p���ă`���[�u�O���瑗�t������s���C���̕p�x�Ŕr�o�Ƌ������J��Ԃ��B�|�{���W���[���������O�����ɖ\�I���邱�ƂȂ��|�{���p���ł���_�ŁC���������͂��߂Ƃ���ٕ��̍����̉\�����ɂ߂ĒႭ���S���������B�|�{���W���[���͒P��g�p�̂��߁C�|�{�I����̊��̃N���[�j���O���ȕւŁC���������̃��X�N���Ⴂ�B�����̓����ɉ����C�]����Z�ōs���Ă����|�{�����������邱�Ƃɂ��C�i���̈��艻�ƗʎY���������ł���B�}2��iPS�זE��ʎ����|�{���uiACE1�̊O�ς������B���S���n���̗p���C10���̔|�{�e���p����iPS�זE�̕��ʔ|�{���\�ł���CiPS�זE�̑�ʔ|�{�ɉ����ăh�p�~���_�o�O��זE�ւ̏��������ɂ����т�����B�ڍׂ͎��͂ʼn�����邪�C��������Đ���Â̎��p���ɍŐ�[�ŃO���[�o���Ɏ��g�ޑ���{�Z�F������Ђ̍Đ��E�זE����v�����g�ɐ��i��1���@���[�i���ꂽ5�j�B
���ݓ����_�˃��{�����_��u���_�ˈ�ÎY�Ɠs�s�́C��_�E�W�H��k�Ќ�̕������Ƃ̈�Ƃ��āC�_�ˌo�ς̊������C�s�������̌���C���ۍv����ړI�ɐݗ�����C��{�\�z�̌������J�n����Ă���2018�N��20���N���}�����B�_�ˈ�ÎY�Ɠs�s�̓��f�B�J���N���X�^�[�C�o�C�I�N���X�^�[�C�V�~�����[�V�����N���X�^�[�̎O�̕���̃N���X�^�[����\������Ă���B�����_�˃��{��2017�N�ɏv�i�����j�H�����_�ˈ�ÃC�m�x�[�V�����Z���^�[�iKCMI�FKobe Center for Medical Innovation�j�ɏ��݂���i�}3�Q�Ɓj�B2019�N3�����݁C������ƁE�x���`���[��Ƃ����萻���ЂɎ���܂�352�Ђ̈�Ê֘A��ƁE�c�̂������O���i�o���C���{�ő勉�̃o�C�I���f�B�J���N���X�^�[�ɐ��������B���v���c�@�l�_�ˈ�ÎY�Ɠs�s���i�@�\�������̖{���C���m��2018�N�̃m�[�x�������w�E��w�܂���܂������Ƃ��N���X�^�[�̐��i������Â��鎖��ƌ����邾�낤�B
�����_�˃��{��2017�N����_�ˈ�ÎY�Ɠs�s�ɎQ�悵6�j�C�s�s���ɋ��_��u���Đ���Õ���̃g�b�v���[�_�[�ƘA�g���C�I�[�v���C�m�x�[�V�����ɂ�莩���|�{�Z�p���R�A�Z�p��iPS�זE�R���זE�̎��p���Ɍ����������J���𐄐i���Ă���B�ȉ��ɓ�̎���ɂ��ďЉ��B
�}4�biPS�זE�R��RPE�זE�V�[�g�̔|�{����������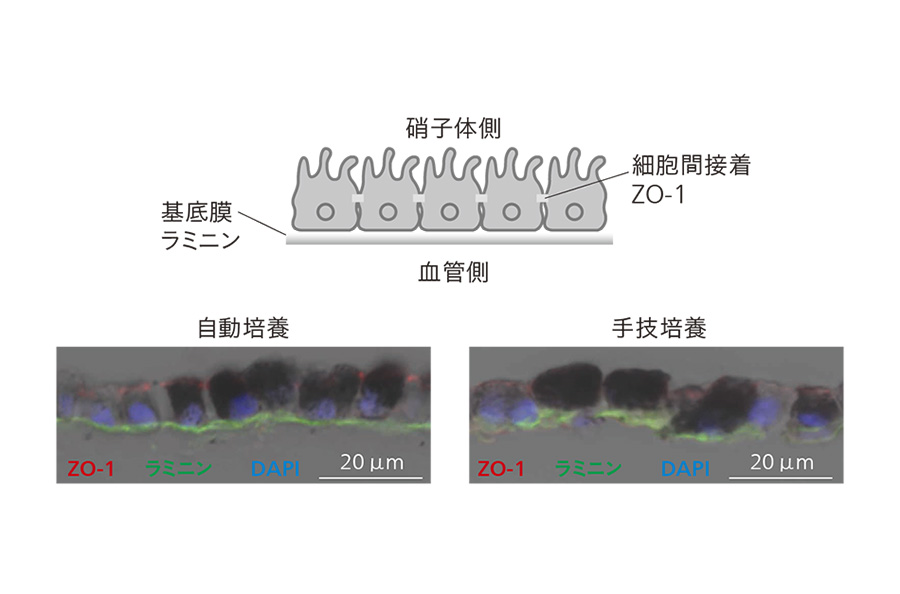 �|�{����RPE�זE�V�[�g�̏c�f�ʂ��זE�Ԑڒ��̃}�[�J�iZO-1�C�ԁj�Ɗ�ꖌ�̃}�[�J�i���~�j���C�j�ɑ�����ٓI�ȍR�̂�p���Ču�����o���s�����BDAPI�i�j�͍זE�̊j�������B
�|�{����RPE�זE�V�[�g�̏c�f�ʂ��זE�Ԑڒ��̃}�[�J�iZO-1�C�ԁj�Ɗ�ꖌ�̃}�[�J�i���~�j���C�j�ɑ�����ٓI�ȍR�̂�p���Ču�����o���s�����BDAPI�i�j�͍זE�̊j�������B
�����_�˃��{�ł́C2016 �N���痝���w����������������v���W�F�N�g���[�_�[��Ƌ����������J�n���CiPS�זE�R��RPE�זE�̃V�[�g���ɂ����ĕ��n�����|�{���������B
����Ǖϐ��͉���ɔ����Ĕ��ǂ��C�Ԗ��̒��S���ɂ��鉩�Ǖ��̋@�\���ቺ���C�ň��̏ꍇ�͎��͂��������Ƃ��������Ꮎ���ł���B���{�ɂ�������ݓI���Ґ���69���l�ɏ��Ɛ��肳��Ă���7�j�C���E�I�Ɍ��Ă����������̑�3�ʂł���C��i��j�����������邱�Ƃɂ��o�ϓI�������傫���B���Âɂ͐i�s��}�����邽�߂ɖ��^���s���邪�C���{�I�Ȏ��Â̂��߂ɂ͏�Q���ꂽ�Ԗ��g�D���ڐA���Â��邱�ƂɂȂ�B1980�N��㔼����C����َ��̖Ԗ����邢�͐���ȖԖ��g�D�̈ꕔ���ڐA���邱�Ƃ��s���Ă������C�ڐA�g�D�ɑ���Ɖu���┽���C�ϗ��I�ȉۑ�⍂���N�P������C�����̉ۑ���������C���S������I�ȈڐA���×p�g�D�����߂��Ă���3�j�B�O�q�̂Ƃ���C�����w�������ł͎���iPS�זE�R����RPE�זE�V�[�g�̍쐻�Ƃ����p��������Ǖϐ��̎��Âɐ������Ă����B�����œ����_�˃��{�ł́C����܂ő̐��זE�R���̊p�����זE�Ȃ�тɌ��o�i�����j�S���זE�̍זE�V�[�g�̔|�{�������Ŏ��т̂���������@�CACE3�iAutomated Cell Culture Equipment 3�j��p���CiPS�זE�R��RPE�זE�V�[�g�̔|�{���������������B�|�{�v���Z�X�͈ȉ��̒ʂ�ł���B
���̌��ʂ�}4�Ɏ����B�זE�Ԑڒ��̌`��������ZO-1�i�ԁj�ƁC��ꖌ�̌`�����������~�j���i�j�̃V�O�i���������|�{�C��Z�|�{�łƂ��Ɍ��o���CiPS�זE�R��RPE�זE�V�[�g�̔|�{���������\�ł��邱�Ƃ��m�F����8�j�B
�}5�b�����|�{�iiACE�j�ō쐻�����זE�̎�Z�|�{�Ƃ̓������]��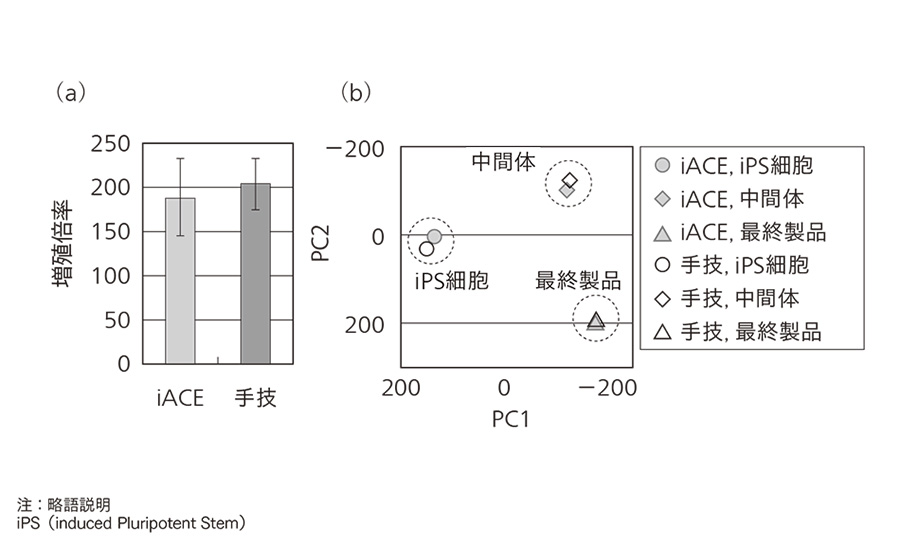 �ia�jiPS�זE��7���Ԃ̑��B�{���̔�r�������B��Z�|�{�͑��u�Ɠ��^�̊J���n��^�e���p�����BiACE:n��10�C��Z:n��3�C�G���[�o�[�́}S.D.
�ia�jiPS�זE��7���Ԃ̑��B�{���̔�r�������B��Z�|�{�͑��u�Ɠ��^�̊J���n��^�e���p�����BiACE:n��10�C��Z:n��3�C�G���[�o�[�́}S.D.
�ib�j��`�q�����v���t�@�C���̔�r�������B�ԗ��I�Ɉ�`�q�����ʂ�]�����C�听�����͂��s�����BiPS�זE����ђ��ԑ̂͂��ꂼ��iACE�Ǝ�Z�|�{�ō쐻���C���ԑ̂���ŏI���i�ւ̉��H�́C�]���@�ō쐻�����B���̍זE���قȂ鐻�����@�ł����Ă��C�ŏI���i�ɈႢ�͏o�Ȃ��B
�܂��C����{�Z�F����C���s��wCiRA�������~������ƂƂ��ɁC2015�N���獑�������J���@�l���{��Ì����J���@�\�iAMED�FJapan Agency for Medical Research and Development�j�u�Đ���Â̎Y�Ɖ��Ɍ������]����ՋZ�p�J�����Ɓv�ɂ����āC�p�[�L���\���a���ÂɌ�����iPS�זE�R���̃h�p�~���_�o�O��זE�̐����v���Z�X�̊J�����s���Ă���B
�p�[�L���\���a�͔]���̃h�p�~���_�o�זE���E�����邱�Ƃʼn^����Q�������N�����_�o�ϐ������ŁC���{�ł͓�a�Ɏw�肳��Ă���B�����ł̊��Ґ���16���l����Ƃ���C���҂̗v���x�������C�Љ�I�R�X�g�̍������a�ƌ�����B���Âɂ͖��^�̂ق�1980�N�ォ��זE�ڐA�ɂ��h�p�~���_�o���[���鎡�Â��s���Ă���C���̗L�����͒m���Ă����B�������C�ڐA����זE������َ��R���ł��邽�߁C�ϗ��ʂ⋟���ʂŖ�肪���邤���C�ڐA�זE�̏��x�̒Ⴓ�ɂ�镛��p���N�����Ă���9�j�B���̂��߁CiPS�זE�R���̃h�p�~���_�o�O��זE���ڐA������@����Ă���CiPS�זE���獂�����������x�ȃh�p�~���_�o�O��זE��������@���C�����~������ɂ���ĊJ�����ꂽ10�j�B���łɓ��������ł����S���ƗL�������m�F����11�j�C����iPS�זE��p����������2018�N�ɊJ�n���ꂽ�BiPS�זE�R���h�p�~���_�o�O��זE���i�J���͑���{�Z�F�����i���Ă���B
�זE���i���ɂ����ẮC��ʂ̍זE����ÃO���[�h�Ő������邽�߂̋Z�p���K�v�ƂȂ�B�����ŁC�����Ǝ��̊��S���n�����|�{�Z�p���CiPS�זE�g��|�{����я��������U���H���ɓK�p���邽�߂ɁC�O�q��iPS�זE��ʎ����|�{���u�iiACE1�j�i�}2�Q�Ɓj���J������12�j�B
��Z�|�{�ł̔|�{�������\�Ȍ��葕�u�ōČ�����Ɠ����ɁC��Z�|�{�Ƃ͍��{�I�ɈقȂ�����C�Ⴆ�Ε��n��Ԃł̔|�{�C�`���[�u����Ă̑��t�E���C�ɂ��ẮC��Z�|�{�ɂ�����]���̔|�{�������������̂��߂ɕύX���邽�тɁC�����|�{�����זE����Z�ɂ��|�{�����זE�Ɠ����̕i����ێ����Ă��邩�C�������s�����B����ɂ�莩���|�{�S�̂̔|�{�菇�i�v���g�R���j���\�z�����B
���̂悤�ɂ��č\�z���������|�{�v���g�R����p���āCiPS�זE�̊g��|�{�Ƃ���ɑ������������U���|�{�������iACE1��p���Ď��{�����B�����|�{�����זE�ۓI�ɉ��������ɁC����{�Z�F���ŏI�H���܂Ői�߂āC�e�H���̍זE�̕i������Z�|�{�Ɣ�r�����B
���̌��ʂ�}5�Ɏ����B�}5�ia�j��iPS�זE�̊g��|�{��̑��B�{���ŁC��Z�|�{�Ǝ����|�{�͂Ƃ��ɓ����x�̑��B�{���ł��������Ƃ��m�F�ł����B�}5�ib�j�́C�g��|�{����iPS�זE�C����я��������U���������ԑ́C�����Ă���ɕ�����i�߂��ŏI���i�̈�`�q������ԗ��I�ɉ�͂��C�听�����͂ɂ���Ă��̃v���t�@�C�����r�������̂ł���B��Z�|�{�C�����|�{�Ƃ��ɓ��l�̃G���A�Ƀv���b�g����邱�Ƃ���C��`�q�������x���ł������̕i����L���Ă��邱�Ƃ��m�F�ł����B
iACE1�͍Đ���×p�זE�̌����ƂȂ�iPS�זE�̑�ʔ|�{���\�ł��邾���łȂ��C�ڒ��|�{�ł���ΐ_�o�����U���ȊO�ɂ��K�p�\�Ȕėp�I���u�ł���B���コ�܂��܂ȍזE�̐����ɓK�p���C�Đ���Â̕��y�����i����j�����Ă������Ƃ��߂����ĊJ���𑱂��Ă����B
���悻10�N���2030�N�ɂ́C�����̓�������ɑ��CiPS�זE�R���̍זE�E�g�D���K�p�����a����������Ă��邩������Ȃ��B�Đ���Â̕��y�̂��߂ɂ́C��×p�זE��ʎY�����C����I�ɋ������Ȃ���Ȃ�Ȃ��B�܂��C�Đ���Â����݂̎�v���_���瑼���_�֊g�傷��ɂ́C�זE�|�{�̋Z�p�ړ]�ɂ����āC�ꏊ��Z�p�҂Ɉˑ����������i���̍זE�����邽�߂ɁC�����|�{�Z�p�͑傫���v���ł���B���̂悤�Ȋϓ_����C�����́C���݂���ߖ����ɂ�����ۑ��j�[�Y�Ɋ�Â��C�Đ���Â̕��y�ɍv���ł��鎩���|�{�Z�p�̊J���Ɉ����������g�ޗ\��ł���B
���Ҏ��g�̍זE����iPS�זE���쐻���C�ړI�̍זE�����ĈڐA���鎩�ƈڐA�ɂ����ẮCiPS�זE�̍쐻�Ɏ��ԂƃR�X�g�������邱�Ƃ��ۑ�ł��邪�C�Ɖu���₪�N����\�����Ⴂ���Ƃ���C���҂ɂƂ��Ă͑傫�ȃ����b�g�����藝�z�̌ʉ���ÂƂȂ肤��B�R�������́C2019�N��2���ɍs��ꂽ�u���̒��ŁC�u2025�N�̑��E�������ŁC���Ҏ��g�̍זE�������}�CiPS�זE���I����v�Əq�ׂ��BiPS�זE�̍쐻�ɂ�����ۑ���������C100���~���x�̒ቿ�i�Œ���ӗ~�����������̂��B�����́C������w�Ȃ�тɋ��s��w�ƘA�g���C�}�C�N�����H��p�����זE�}�j�s�����[�V�����Z�p���x�[�X�Ɏ���iPS�זE�쐻�Ɍ������Z�p�J���Ɏ��g��ł���B��̓I�ȖڕW�Ƃ���ׂ��R�X�g�Ǝ����������ꂽ���Ƃ��݂ɁC������I�[�v���C�m�x�[�V�����ɂ���w�̌����J���̉�����}�肽���B
�{�e�ł́CiPS�זE��p�����Đ���Â̎��p���Ɍ����������Ɠ����_�˃��{�̎��g�݂ɂ��ďq�ׂ��B
�Đ���Â������̌��N�����Љ���������邽�߂ɂ́C�܂������n�[�h�����������邪�C���E�̒N�����Đ���Â����C��a���������ꂽ�Љ�̎����ɍv�����Ă��������B
�{�e�ŏЉ�����e�̈ꕔ�́C�����Ȋw�Ȑ�[�Z���̈�C�m�x�[�V�����n�o���_�`���v���O�����u�Đ���Ö{�i���̂��߂̍Ő�[�Z�p�Z�����_�v�C���{��Ì����J���@�\�iAMED�j�uJP18be0104016�v�ɂ����Ď��{�����B�{�����J���ɂ�����C���w���E�����͂����������������q��ȑ�w�C���s��wiPS�זE�������C�����w�������C����{�Z�F������ЁC�_�ˈ�ÎY�Ɠs�s���i�@�\�C�_�ˎs�̊W�e�ʂɊ��Ӑ\���グ��B